Thermodynamique classique
Description macroscopique en thermodynamique
- 1h40min
- 23 inscrits
- Moyen
- Version du 06/08/2024
En thermodynamique classique, on s'intéresse à des systèmes composés d'un très grand nombre de particules.
A l'échelle macroscopique, l'expérience montre qu'on peut mesurer des grandeurs physiques (température, volume, pression, quantité de matière) qui n'ont de sens qu'à cette échelle, et qui suffisent à décrire complètement l'évolution du système.
Ces grandeurs ne jouent aucun rôle en mécanique. Pourtant, leur évolution relative semble obéir à des lois, selon les matériaux considérés. Dans le cas des gaz, il apparait même qu'à faible pression, ces lois deviennent universelles et ne dépendent plus de la nature des gaz considérés.
Dans ce cours, on va introduire un cadre conceptuel très général (système, variable d'état, fonction d'état, équation d'état) permettant de décrire tout système thermodynamique. En prenant l'exemple des gaz aux faibles pressions, on exhibera, à partir des lois empiriques historiques sur leur comportement thermoélastique, la loi du gaz parfait.
Ce que vous allez apprendre
- Définir un système en thermodynamique
- Différencier les systèmes ouvert, fermé, isolé
- Définir un variable, une fonction et une équation d'état
- Distinguer une grandeur extensive et une grandeur intensive
- Enoncer les postulats de la thermodynamique classique
- Comprendre le comportement asymptotique du gaz parfait
- Définir et donner l'intérêt des coefficients thermoélastiques
- Connaître les coefficients thermoélastiques pour un gaz parfait
- Etablir les coefficients thermoélastiques à partir d'une équation d'état
- Démontrer l'équation d'état du gaz parfait à partir des résultats empiriques des expériences historiques
- Etablir une équation d'état à partir de coefficients thermoélastiques
La surface en question peut être fermée (alors le nombre de particules est constant) ou ouverte (alors le nombre de particules peut varier).
On notera que les particules peuvent être sans masse (cas des photons) et que le système peut être dans tout état physique (solide, liquide, gaz, etc.), de sorte que la surface peut être rigide ou déformable.
Ainsi, la différence essentielle entre la description mécanique et la description thermodynamique résulte du nombre de particules prises en compte, de leurs interactions et, par conséquent, des grandeurs physiques permettant de décrire un système.
Par contre, un système fermé peut échanger de l'énergie (sous forme de chaleur ou de travail). Un système isolé est un système fermé qui, de plus, n'échange pas d'énergie. Il n'échange donc ni matière, ni énergie.
Par contre, pour chaque système thermodynamique étudié, il n'existe qu'un seul environnement. L'environnement est le complémentaire du système dans l'Univers. En conséquence, il existe une multitude d'environnement.
Une fonction d'état est une fonction des variables d'état. Par conséquence, elle n'est définie et mesurable qu'à l'équilibre du système.
Une équation d'état est une équation mathématique reliant plusieurs variables d'état entre elles. Elle n'est donc, elle aussi, valide qu'à l'équilibre.
Par contre, cette équivalence n'est pas toujours possible. Ainsi, on ne peut pas exprimer le volume $V$ d'un gaz de Van der Waals de façon analytique, en fonction de $p$, de $n$ et de $T$.
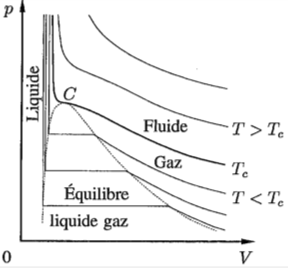
Le gaz parfait est un modèle qui représente bien n'importe quel gaz, pourvu que sa densité soit suffisamment faible (ou sa pression relativement faible ou son volume suffisamment grand). L'équation d'état est donc valide dans ces domaines extrêmes.
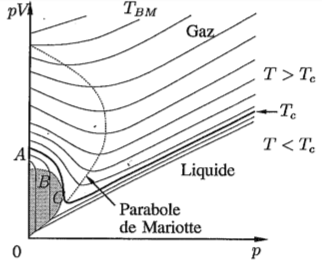
Le gaz de Van der Waals est un modèle qui représente bien n'importe quel gaz dans un domaine moins extrême de densité, pression ou volume. Il tient compte des interactions entre particules, au-delà des seules collisions.
Le gaz est représenté par les coefficients $a$ et $b$. De ce fait, l'équation de Van der Waals est moins "universelle" que celle du gaz parfait.
(i) L'état thermodynamique d'un système à l'équilibre peut être décrit par un nombre restreint de variables d'état.
(ii) Lors d'une évolution entre 2 états thermodynamiques d'équilibre, la variation d'une fonction d'état ne dépend pas du chemin suivi.
On peut voir le premier postulat comme la définition d'un état d'équilibre et le second postulat comme la définition d'une variable d'état. En d'autres termes, une variable d'état est une grandeur mesurable, macroscopique, définie à l'équilibre ... dont la variation ne dépend pas du chemin suivi. Si cette variation dépend du chemin suivi, alors il ne s'agit pas d'une variable d'état.
Au contraire, une grandeur intensive est indépendante de la quantité de matière du système.
On notera qu'une grandeur qui n'est pas intensive n'est pas nécessairement extensive, et réciproquement.
L'une des propriétés essentielles d'un coefficient thermoélastique est d'être intensif. De plus, on les définit positifs.
On le mesurerait donc en maintenant la pression constante, mais en faisant varier simultanément le volume et la température.
Pour obtenir son expression, on utilise les équations d'état :
(i) Pour le gaz parfait :
$$pV = nRT \implies p \frac{\partial V}{\partial T}\bigg|_{p} = nR \implies \alpha = \frac{1}{V} \frac{\partial V}{\partial T}\bigg|_{P} = \frac{nR}{pV} = \frac{1}{T}$$ (ii) Pour le gaz de Van der Waals :
$$\bigg( p+a\Big(\frac{n}{V}\Big)^{2} \bigg) \big(V-bn\big) =n RT \implies \bigg( p- 2 a \frac{n^{2}}{V^{3}} \frac{\partial V}{\partial T}\bigg|_{p} \bigg) \big(V-bn\big) + \bigg( p+a\Big(\frac{n}{V}\Big)^{2} \bigg) \frac{\partial V}{\partial T}\bigg|_{p} = nR$$ puis on isole $\frac{\partial V}{\partial T}\bigg|_{p}$ avant d'exprimer $\alpha$ : $$p \big(V-bn\big) - 2 a \frac{n^{2}}{V^{3}} \frac{\partial V}{\partial T}\bigg|_{p} \big(V-bn\big) + \bigg( p+a\Big(\frac{n}{V}\Big)^{2} \bigg) \frac{\partial V}{\partial T}\bigg|_{p} = nR$$ $$ \frac{\partial V}{\partial T}\bigg|_{p} = \frac{nR - p \big(V-bn\big) }{p + a\Big(\frac{n}{V}\Big)^{2} - 2 a \frac{n^{2}}{V^{3}} \big(V-bn\big) }$$ $$\alpha = \frac{1}{V} \frac{\partial V}{\partial T}\bigg|_{P} = \frac{1}{V} \frac{nR - p \big(V-bn\big) }{p + a\Big(\frac{n}{V}\Big)^{2} - 2 a \frac{n^{2}}{V^{3}} \big(V-bn\big) }$$ Dans les deux cas, on peut également calculer $\frac{\partial T}{\partial V}\bigg|_{p}$ puis inverser pour trouver $\alpha$.
On le mesurerait donc en maintenant le volume constant, mais en faisant varier simultanément la température et la pression.
Pour obtenir son expression, on utilise les équations d'état :
(i) Pour le gaz parfait :
$$pV = nRT \implies V \frac{\partial p}{\partial T}\bigg|_{V} = nR \implies \beta = \frac{1}{p} \frac{\partial p}{\partial T}\bigg|_{V} = \frac{nR}{pV} = \frac{1}{T}$$ (ii) Pour le gaz de Van der Waals :
$$\bigg( p+a\Big(\frac{n}{V}\Big)^{2} \bigg) \big(V-bn\big) =n RT \implies \frac{\partial p}{\partial T}\bigg|_{V} \big(V-bn\big) = nR \implies \beta = \frac{1}{p} \frac{\partial p}{\partial T}\bigg|_{V} = \frac{1}{p} \frac{nR}{V-bn}$$ On vérifie bien que ces formules coïncident lorsque $V \longrightarrow + \infty$
On le mesurerait donc en maintenant la température constante, mais en faisant varier simultanément le volume et la pression.
Pour obtenir son expression, on utilise les équations d'état :
(i) Pour le gaz parfait :
$$pV = nRT \implies V = \frac{nRT}{p} \implies \frac{\partial V}{\partial p}\bigg|_{T} = - \frac{nRT}{p^{2}} \implies \chi_{T} = - \frac{1}{V} \bigg( - \frac{nRT}{p^{2}} \bigg) = \frac{nRT}{Vp^{2}} = \frac{1}{p}$$ (ii) Pour le gaz de Van der Waals :
$$\bigg( p+a\Big(\frac{n}{V}\Big)^{2} \bigg) \big(V-bn\big) = n RT \implies p = \frac{nRT}{V-bn}-a \bigg( \frac{n}{V} \bigg)^{2} \implies \frac{\partial p}{\partial V}\bigg|_{T} = - \frac{nRT}{\big( V-bn \big)^{2}}+2a\frac{n^{2}}{V^{3}}$$ d'où: $$\chi_{T} = -\frac{1}{V} \frac{\partial V}{\partial p}\bigg|_{T} = -\frac{1}{V} \frac{1}{- \frac{nRT}{\big( V-bn \big)^{2}}+2a\frac{n^{2}}{V^{3}}}=\frac{1}{V}\frac{1}{\frac{nRT}{\big( V-bn \big)^{2}}-2a\frac{n^{2}}{V^{3}}} \underset{V \longrightarrow + \infty}{\longrightarrow} \frac{V}{nRT} = \frac{1}{p}$$